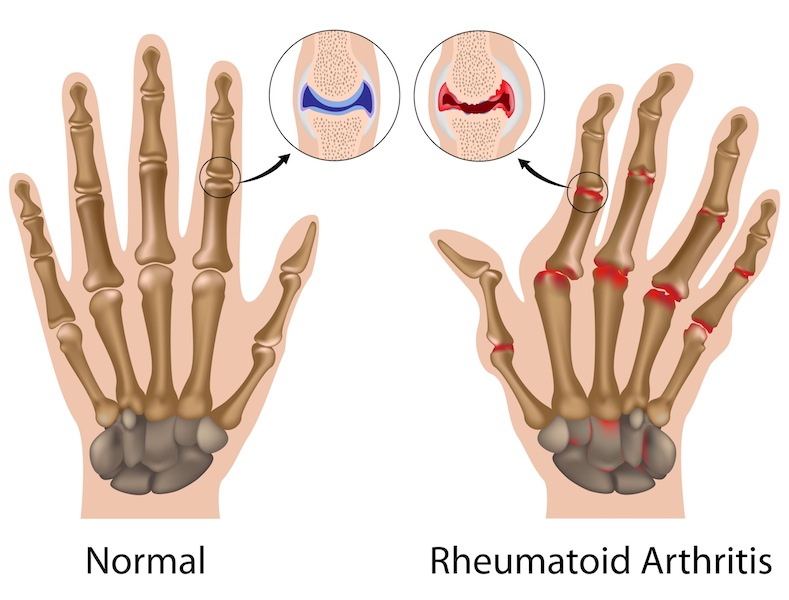
I farmaci biosimilari possono rappresentare un ulteriore passo avanti nel trattamento nell’adulto dell’artrite reumatoide da moderata a grave, dell’artrite psoriasica, della spondiloartrite assiale non radiografica e della psoriasi a placche?
Samsung Bioepis, la joint venture tra Samsung Biologics e Biogen, annuncia infatti di aver ottenuto l’opinione positiva da parte del Comitato per i medicinali per uso umano (Committee for Medicinal Products for Human Use, CHMP) dell’Agenzia Europea del Farmaco in merito all’autorizzazione all’immissione in commercio del farmaco biosimilare di etanercept, precedentemente noto SB4. L’opinione positiva sara’ ora trasmessa alla Commissione europea (CE), responsabile del rilascio dell’autorizzazione all’immissione in commercio per i medicinali nell’Unione Europea (UE). Se approvato, il farmaco sara’ il primo biosimilare di etanercept disponibile in UE e il primo trattamento biosimilare sottocutaneo anti-TNF disponibile in Europa. Il biosimilare di etanercept e’ un farmaco sperimentale sviluppato come biosimilare rispetto al prodotto originatore. “La raccomandazione positiva del CHMP per il biosimilare di etanercept e’ un grande passo avanti per i pazienti, i medici e le autorita’ sanitarie in Europa. I biosimilari hanno il potenziale di migliorare l’accesso a importanti trattamenti biologici per i pazienti che ne hanno bisogno – ha affermato Alpna Seth, vicepresidente, responsabile dei biosimilari di Biogen – In qualita’ di leader nelle biotecnologie, grazie a un’esperienza di oltre 35 anni nello sviluppo, produzione e commercializzazione di farmaci biologici avanzati, siamo grado di sfruttare la nostra eccellenza produttiva per offrire un portfolio di terapie biosimilari anti-TNF”. L’opinione positiva del CHMP si e’ basata su una serie di dati preclinici fondati su sofisticati metodi di analisi molecolare, sviluppi tecnici ed esperienza nella produzione di tali prodotti, insieme a solidi dati clinici di confronto di Fase 1 e 3 sul biosimilare di etanercept.Lo studio di fase 3, a 52 settimane in doppio cieco, ha randomizzato 596 pazienti, in 70 centri di 10 Paesi, con una forma da moderata a grave di artrite reumatoide persistente nonostante la terapia con il metotrexato, che hanno ricevuto il biosimilare di etanercept o il farmaco originatore in un rapporto di 1:1. I risultati – viene riferito – hanno mostrato un tasso di risposta ACR20 dell’80,8% nei pazienti trattati con il biosimilare rispetto all’81,5% nel braccio trattato con il farmaco originatore. Il profilo di sicurezza del biosimilare e’ stato comparabile a quello dell’originatore. GNM .
Questo sito utilizza i cookies per migliorare la tua esperienza di navigazione sul sito. Di questi, i cookies che sono categorizzati come necessari sono memorizzati nel tuo browser come essenziali per il funzionamento delle funzionalità di base del sito. Usiamo inoltre cookies di terze parti che possono aiutarci ad analizzare e capire capire come usi il sito. Questi cookies saranno memorizzati nel tuo browser solo con il tuo consenso. Inoltre hai anche dei cookies opzionali. Ma la disattivazione di questi cookies potrebbe avere effetti sulla tua esperienza di navigazione.
Per saperne di più sulla nostra cookie policy clicca qui: Privacy & Cookie Policy