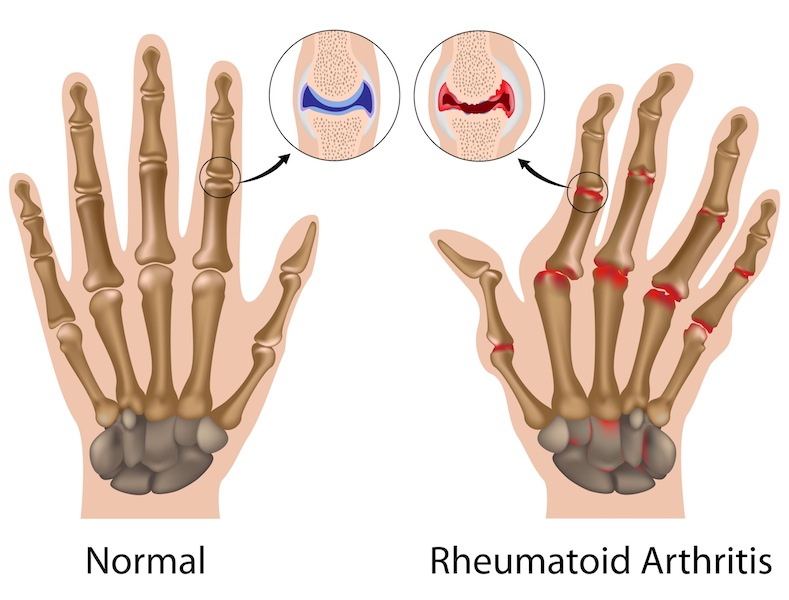
Biogen ha annunciato un ulteriore passo avanti nel suo impegno in ambito biosimilari. Samsung Bioepis, la joint venture tra Samsung Biologics e Biogen ha ricevuto l’opinione positiva da parte del Comitato per i medicinali per uso umano (Committee for Medicinal Products for Human Use, CHMP) dell’Agenzia Europea del Farmaco in merito all’autorizzazione all’immissione in commercio del farmaco biosimilare di etanercept, precedentemente noto come SB4.
L’opinione positiva sarà ora trasmessa alla Commissione europea (CE), responsabile del rilascio dell’autorizzazione all’immissione in commercio per i medicinali nell’Unione Europea (UE). Se approvato, il farmaco sarà il primo biosimilare di etanercept disponibile in UE e il primo trattamento biosimilare sottocutaneo anti-TNF disponibile in Europa. “La raccomandazione positiva del CHMP per il biosimilare di etanercept è un grande passo avanti per i pazienti, i medici e le autorità sanitarie in Europa. I biosimilari hanno il potenziale di migliorare l’accesso a importanti trattamenti biologici per i pazienti che ne hanno bisogno.” – ha affermato Alpna Seth, Vicepresidente, responsabile dei biosimilari di Biogen – “In qualità di leader nelle biotecnologie, grazie a un’esperienza di oltre 35 anni nello sviluppo, produzione e commercializzazione di farmaci biologici avanzati, siamo grado di sfruttare la nostra eccellenza produttiva per offrire un portfolio di terapie biosimilari anti-TNF”. L’opinione positiva del CHMP si è basata su una serie di dati preclinici fondati su sofisticati metodi di analisi molecolare, sviluppi tecnici ed esperienza nella produzione di tali prodotti, insieme a solidi dati clinici di confronto di Fase 1 e 3 sul biosimilare di etanercept[i],[ii]. Lo studio di fase 3, a 52 settimane in doppio cieco, ha randomizzato 596 pazienti, in 70 centri di 10 Paesi, con una forma da moderata a grave di artrite reumatoide persistente nonostante la terapia con il metotrexato, che hanno ricevuto il biosimilare di etanercept o il farmaco originatore in un rapporto di 1:1. I risultati hanno mostrato un tasso di risposta ACR20 dell’80,8% nei pazienti trattati con il biosimilare rispetto all’81,5% nel braccio trattato con il farmaco originatore. Il profilo di sicurezza del biosimilare è stato comparabile a quello dell’originatore. Il biosimilare di etanercept Il biosimilare di etanercept, precedentemente noto in Europa come SB4, è un farmaco sperimentale sviluppato come biosimilare rispetto al prodotto originatore. Se approvato, il farmaco sarà essere indicato in Europa per il trattamento nell’adulto dell’artrite reumatoide da moderata a grave, dell’artrite psoriasica, della spondiloartrite assiale non radiografica e della psoriasi a placche.
[i] Vencovský J, et al. A Phase III, Randomized, Double-blind Clinical Study Comparing SB4, an Etanercept Biosimilar, with Etanercept Reference Product in Patients with Moderate to Severe Rheumatoid Arthritis despite Methotrexate Therapy (52-week Results). Presentato all’American College of Rheumatology, 9 novembre 2015, San Francisco, CA, USA. [ii] Lee Y J, et al. A Phase I Pharmacokinetic Study Comparing SB4, an Etanercept Biosimilar, and Etanercept Reference Product In Healthy Male Subjects. Presented at the European League Against Rheumatism, 13 June 2015, Rome, Italy. Samsung Bioepis data.
GNM