Negli Usa approvato Belimumab, nuovo anticorpo monoclonale contro il LES. Una buona notizia: ma come ricorda Gabriella Voltan, presidente AMARV, i pazienti italiani dovranno aspettare ancora un po’
di Andrea C. Cammarata
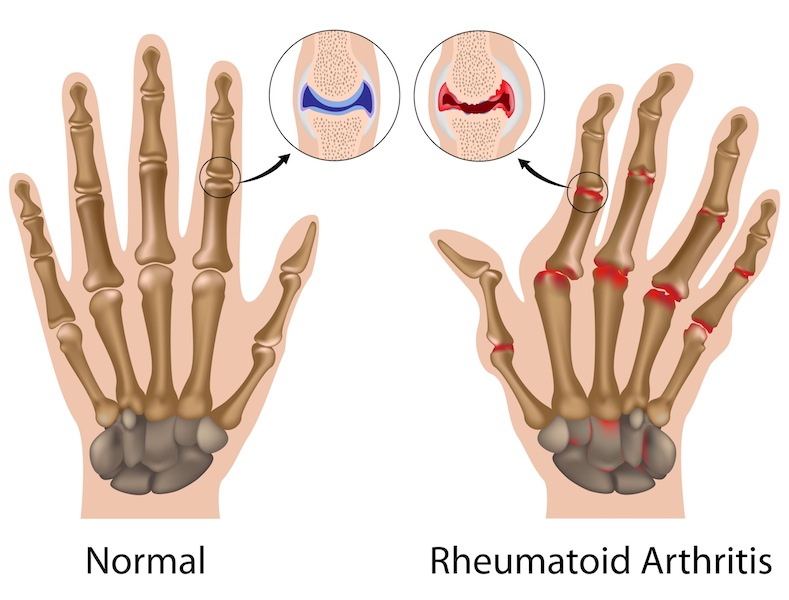
La Food and Drug Administration americana ha detto sì. E nel marzo di quest’anno ha ufficialmente dato il via libera al belimumab nel trattamento del Lupus Eritematoso Sistemico. Si tratta del primo farmaco contro questa malattia, che ancora oggi costringe i pazienti a un percorso terapeutico molto complesso: le armi attualmente a disposizione contro il LES, infatti, si limitano a farlo regredire fino a uno stato di remissione, che comporta comunque disagi fisici e la necessità di tenerlo costantemente sotto controllo.
La nuova molecola, che arriva dai laboratori di GlaxoSmithKline e Human Genome Sciences, e accende nei malati la speranza di condurre una vita il più possibile normale, è stata sviluppata grazie al lavoro di Richard A. Lerner, presidente dello Scripps Research Institute di La Jolla, in California, una delle principali organizzazioni indipendenti di ricerca biomedica del mondo, che già in passato ha messo a segno parecchi colpi nel campo dell’immunologia, della biologia cellulare e molecolare, delle neuroscienze e nello sviluppo di nuovi vaccini.
Il belimumab, anticorpo monoclonale completamente umano, agisce contro una proteina specifica chiamata BLyS (B-Lymphocyte Stimulator), scoperta nel 1997 proprio dai ricercatori della Human Genome Science, e che ha un ruolo importante nell’attivazione e la sopravvivenza dei linfociti B. Inibendo l’azione della BLyS, belimumab impedisce gli attacchi del sistema immunitario contro l’organismo.
Lerner e i suoi collaboratori sono arrivati alla sintesi di questa molecola grazie a decenni di studi sulla natura degli anticorpi umani e animali. La prima tappa della scoperta risale infatti al 1991, quando i ricercatori idearono una tecnica di clonaggio di anticorpi umani grazie all’uso di virus modificati. La grande produzione di immunoglobuline scaturita da tale scoperta ha permesso negli ultimi vent’anni di costruire una grande “libreria di anticorpi”. Studiando la natura di ognuno dei componenti di questo enorme archivio, è stato possibile capire quali potessero essere usati per il trattamento di alcune malattie. Combinando tra loro le diverse componenti, i ricercatori hanno sintetizzato molecole in grado agire esattamente come gli anticorpi stessi, cioè di legarsi a target specifici per inibirne l’azione cellulare, come per l’appunto fa il belimumab.
Ma la guarigione è ancora lontana
Il commento di Gabriella Voltan, presidente dell’Associazione malati reumatici del Veneto
Presidente, dunque una buona notizia per i pazienti con LES?
Certamente l’approvazione di belimumab è un passo avanti, perché un principio attivo del tutto innovativo che permette di tenere sotto controllo la malattia in maniera assai migliore rispetto ai trattamenti utilizzati fino a questo momento: parlo di quelle terapie complesse che comprendono l’uso di antimalarici, cortisone, parecchi antinfiammatori non steroidei e immunosoppressori, che i malati conoscono bene. Ma attenzione a non farsi troppe illusioni. Perché, nonostante tutto, il Lupus resta: se si sospende la somministrazione dell’anticorpo monoclonale, gli attacchi del sistema immunitario contro l’organismo riprendono. La vera notizia, quindi, è che ora, grazie a questo nuovo farmaco, i soggetti affetti da LES potranno controllare meglio la loro malattia con un percorso terapeutico meno complesso. Ma purtroppo non riusciranno a debellarla del tutto.
Ora che la FDA ha dato il via libera, quali saranno i tempi di immissione del belimumab sul nostro mercato farmaceutico?
La GlaxoSmithKline ha presentato domanda di commercializzazione del farmaco all’Agenzia europea del farmaco nel giugno del 2010, e tale richiesta è attualmente in fase di valutazione. In genere i tempi d’attesa per ottenere le autorizzazioni necessarie in questi casi vanno dai sei mesi ad un anno. Successivamente, ottenuto il via libera dall’EMA, toccherà all’Agenzia italiana del farmaco (AIFA) aprire un dossier sul belimumab per poter poi rilasciare l’autorizzazione d’immissione in commercio. A quel punto, sempre che fino ad allora sia andato tutto bene, i possibili rallentamenti tipici del nostro paese potrebbero essere causati da complicazioni introdotte nel processo di commercializzazione da parte delle Regioni. In altri termini, mi pare difficile che i pazienti italiani vedano il farmaco sugli scaffali prima di un anno e mezzo.